新股前瞻丨二度闖關港交所,6輪融資身價翻40倍的荃信生物值不值得全信?
智通財經APP獲悉,江蘇荃信生物醫藥股份有限公司(以下簡稱“荃信生物”)於10月3日更新招股書,繼續推進港交所主板上市進程,中金公司擔任獨家保薦人。據悉,該公司曾於2023年3月31日向港交所主板遞交過上市申請。
國內自免行業快速增長,荃信生物6輪融資身價翻超40倍
據了解,荃信生物成立於2015年,是一家完全專注於針對自身免疫及過敏性疾病生物療法的臨牀階段生物科技公司,產品管线涵蓋了在中國自身免疫和過敏性疾病有明顯醫療需求的四個主要領域,即皮膚、風溼、呼吸道和消化道疾病。
由於治療自身免疫疾病方面的生物藥物在中國獲批數量有限,加上MNC开發的重磅藥物相關治療費用高以及缺乏對自身免疫疾病相關意識和教育,中國的自免疾病藥物可及性和治療依從性都比較低。
盡管過往發展不足,中國自身免疫及過敏性疾病藥物市場近年來一直在變化。由跨國公司开發的多種重磅藥物在中國獲得批准,並納入國家醫保。雖然單價下降,但銷售額卻飆升。因此,中國用於自身免疫及過敏性疾病的生物藥物仍有巨大的市場潛力。意識到巨大的市場潛力後,越來越多的中國制藥公司开始進行自身免疫及過敏性疾病藥物的研發並取得明顯進步。
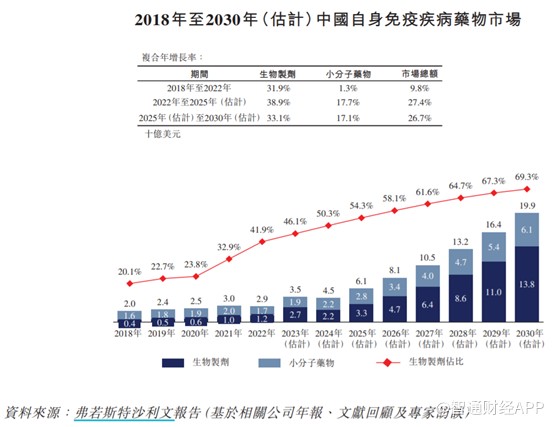
鑑於中國龐大的患者群體及自身免疫疾病創新療法的進步,中國自身免疫疾病藥物市場有望快速增長,由2018年的20億美元增長至2022年的29億美元,復合年增長率爲9.8%,估計2030年將達到199億美元,2022年至2030年的復合年增長率爲27.0%。估計生物藥在中國自身免疫疾病藥物市場中的份額將由2022年的41.9%增加至2030年的69.3%。
巨大的市場潛力,也使得荃信生物獲得不少知名機構的青睞,包括華東醫藥、洪泰基金、經緯創投、勤智資本、瑞享源基金、倚鋒資本、同創偉業、朗瑪峰創投等。
不僅如此,經過6輪的融資後,荃信生物的身價也暴漲,從Pre-A輪得8400萬元人民幣(單位,下同)增長至C輪的35.28億元,身價漲超40倍。
那么備受機構追捧且估值暴漲的荃信生物又有和過人之處呢?
兩款核心產品競爭激烈,QX001S商業化能否成功還看合作夥伴
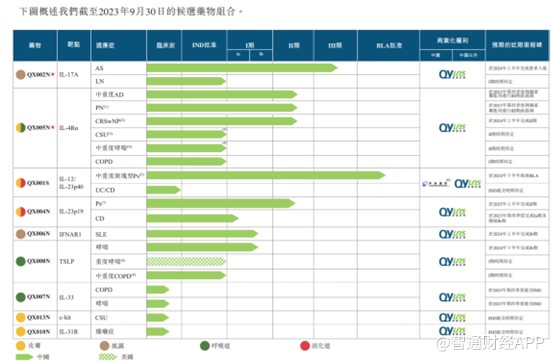
據智通財經APP了解,目前荃信生物有兩款自研的核心產品QX002N及QX005N,此外還有7種管线候選藥物,其中4種處於臨牀階段,適應症爲自身免疫和過敏性疾病中的四個主要領域,皮膚、風溼、呼吸道及消化道疾病。預期首個商業化藥物爲QX001S烏司奴單抗生物類似藥,目前已向中國國家藥監局遞交上市申請。
先看其QX002N,該產品是首批獲得國家藥監局IND批准用於治療AS的國產IL-17A抗體之一,適應症爲AS(強直性脊柱炎)及LN(狼瘡性腎炎)。針對AS適應症,QX002N在臨牀試驗中顯示出良好治療效果,在II期臨牀試驗中,每4周一次接受QX002N(160 mg)的受試者在第16周時的ASAS20及ASAS40應答率分別達到60.0%及40.0%。公司計劃於2023年9月啓動III期臨牀試驗,並預計在2025年下半年完成。
針對LN適應症,公司於2021年10月公司獲得IND批准,並預計QX002N用於治療AS的新藥申請批准後繼續开發用於治療LN適應症。截至最後實際可行日期,荃信生物尚未啓動QX002N用於治療LN的任何臨牀試驗。
目前還沒有治愈AS的方法,現有的治療方法旨在控制炎症,防止關節損傷並緩解症狀。近幾十年來,細胞因子(調節其他免疫系統細胞生長和活性的小信號蛋白)在AS發展中的關鍵作用得到了密切研究,靶向促炎細胞因子的生物制劑,尤其是腫瘤壞死因子(TNF)和白細胞介素(IL),已推薦用於接受一线傳統治療後仍具有高疾病活動性的AS患者的二线治療。
根據弗若斯特沙利文的資料,中國的AS患者人數在2022年達到390萬人,預計未來十年將保持相對穩定。相當一部分AS患者在成年早期或青春期首次出現症狀,需要長期治療以控制疾病進展。
盡管目前沒有治愈AS的方法,但截至最後實際可行日期,中國有19種生物藥獲批用於AS治療,包括17種TNF抑制劑(包括阿達木單抗及7種阿達木單抗生物類似藥)及2種IL-17A抗體藥物(即司庫奇尤單抗及依奇珠單抗),兩者也均獲FDA批准用於治療成人AS。不僅如此,除QX002N外,中國有21種適用於AS的候選生物藥物處於臨牀階段,包括12種TNF抑制劑(包括8種擬議阿達木單抗生物類似藥)及9種IL-17抑制劑。
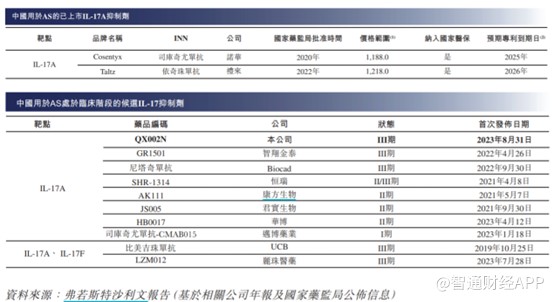
盡管目前國內僅諾華及禮來的IL-17A抑制劑獲批上市,但處於III期臨牀的國內企業並不少,並且從進度來看,荃信生物進入III期臨牀試驗的時間最晚,由此可見,在AS這一適應症方面,荃信生物並不佔優。
不僅如此,除了傳統及生物療法外,輝瑞公司的托法替尼(一種小分子詹納斯激酶(JAK)抑制劑)亦已獲FDA及國家藥監局批准用於AS治療。JAK是一個信號分子家族,參與各種細胞因子受體細胞免疫信號的細胞內轉導。JAK抑制劑在緩解症狀和減少炎症方面對AS患者顯示出明顯的臨牀益處。然而,由於JAK抑制劑的安全性仍然存在擔憂,因此,FDA建議僅對一種或多種TNF抑制劑不耐受或無應答的AS患者使用托法替尼。
可見,盡管AS這一適應症國內具有較大的开發潛力,但市場競爭已經十分激烈,而且按研發進度來看,荃信生物也很難拿到優勢,加上目前公司並未有商業經驗,其上市後商業化進程如何仍具有較大的不確定性。
再看LN這一適應症,截至最後實際可行日期,貝利木單抗是唯一獲FDA或國家藥監局批准用於治療LN的靶向生物藥。中國有11種用於治療LN的候選生物藥物處於臨牀階段,其中3種爲IL-17抑制劑,其他正處於研究階段的靶點包括B細胞膜蛋白,如CD80/CD86及CD20。LN這一適應症競爭相對好一些,但亦有其他靶點在开發,並且荃信生物的LN適應症尚未开發,因此短期內也難看到成效。
再看公司的第二款核心產品QX005N。該產品是一種針對白介素4受體α亞基(IL-4Rα)的重組人源化IgG4單克隆抗體。IL-4Rα是一種經充分驗證的廣泛作用靶點,可控制IL-4及IL-13的信號傳導,這對於2型炎症(一種支持多種慢性過敏性疾病的病理生理學的免疫應答模式)的發生至關重要。IL-4Rα抑制劑在全球範圍內就20個適應症處於开發階段,其中包括5個獲批適應症及15個處於臨牀階段。
目前,荃信生物正在开發QX005N得6種適應症,包括成人中重度AD(特應性皮炎)、PN(結節性癢疹)、CRSwNP(慢性鼻竇炎合並鼻息肉)、CSU(慢性自發性蕁麻疹)、中重度哮喘及COPD(慢性阻塞性肺病)。其中成人中重度AD、PN及CRSwNP適應症正進行II期臨牀試驗評估;CSU、中重度哮喘及COPD適應症均已獲得藥監局IND批准。
先看AD適應症,AD是一種皮膚免疫介導的炎症性疾病,會導致皮膚幹燥、發癢及發炎,通常發生於幼兒,但任何年齡均可發生。根據弗若斯特沙利文的資料,中國的AD患病人數由2018年的6400萬人增至2022年的7030萬人,且預計於2030年將達到7850萬人。20%的患者患有中重度AD。
截至最後實際可行日期,度普利尤單抗(Dupixent)是中國唯一一款獲國家藥監局批准用於治療AD的生物藥。自度普利尤單抗從2017年推出以來,其全球銷售額從2017年的2.57億美元大幅增加至2022年的86.81億美元,復合年增長率爲102.3%。自2020年在中國獲批以來,度普利尤單抗的中國銷售額(由賽諾菲披露)亦從2020年的1370萬美元大幅增加至2022年的2.48億美元,復合年增長率爲325.0%。表明中國的臨牀需求嚴重未得到滿足,市場潛力巨大。
度普利尤的成功,亦吸引中國大批藥企研發AD這一適應症藥物。截至最後可行性日期,除QX005N外,中國有16種AD候選生物藥物處於臨牀階段,其中9種爲IL-4Rα抑制劑,其他已披露的在研靶點包括IL-13、TSLP、 IL-33、ST2、CD200R、OX40及IL-2R。
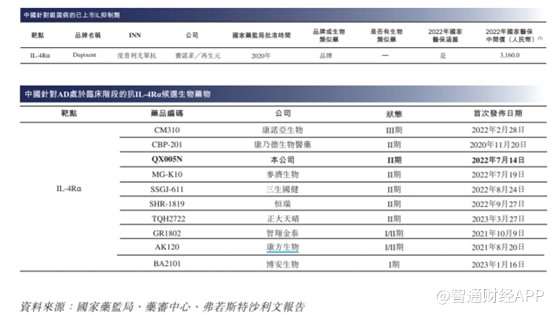
不難看出,AD這一適應症目前市場競爭亦十分激烈,國內臨牀最快的藥企爲康諾亞生物,目前已進入III期臨牀試驗,II期臨牀試驗的企業有6家。就臨牀進展而言,荃信生物的QX005N有望成爲國內前三家獲批的企業。伴隨着後續藥企的开發,這一適應症競爭亦將進入白熾化階段。
再看PN適應症,目前也僅度普利尤單抗一款產品獲得FDA及國家藥監局上市批准,且中國尚無獲批准用於治療PN的生物藥物。截至同日,中國僅有兩種用於治療PN的候選生物藥物處於臨牀階段。
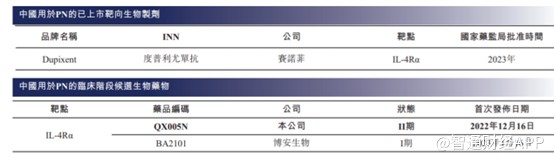
在這一適應症上,市場競爭十分寬裕,且荃信生物的QX005N臨牀進展最快,有望成爲國內首家獲批上市的企業。不過這一適應症市場也相對較小,根據弗若斯特沙利文的資料,2022年中國的PN患者爲200萬人,預計2030年將約達到210萬人。不難看出,這適應症後續的市場基本上沒有增長空間,因此QX005N上市後在這一適應症上的成長空間十分有限。
再看CRSwNP適應症,截至最後實際可行日期,僅三種生物制劑獲FDA批准用於治療CRSwNP,而中國用於CRSwNP的候選生物藥物主要包括IL-4Rα抑制劑、IL-5抑制劑及TSLP抑制劑,尚未有一種生物制劑獲批上市。
截至最後實際可行日期,中國有14種用於CRSwNP的候選生物藥物處於臨牀階段,包括六種IL-4Rα抑制劑、三種IL-5抑制劑、四種TSLP抑制劑及一種IL-5Rα抑制劑。
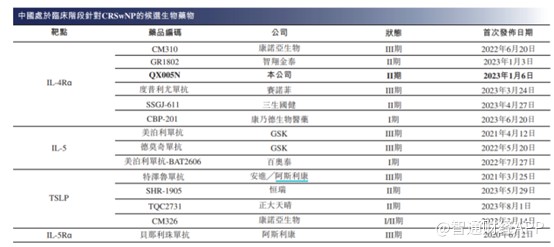
鑑於目前國內尚未有生物藥獲批上市,CRSwNP市場仍舊空白一片,因此首家獲批上市的企業將有望獲得較大的市場份額。不過已有多家藥企處於III期臨牀狀態,其中不乏國際巨頭企業,而荃信生物的QX005N尚處於II期臨牀階段,因此在待其上市後,面臨的競爭不僅僅是IL-4Rα這一靶點,還將面臨IL-5、TSLP以及IL-5Rα這些靶點的競爭。
如此看來,盡管荃信生物的QX005N已經开展多個適應症,但進度較快的三個適應症中,市場空間較大的則將面臨十分激烈是市場競爭,且在臨牀進展上荃信生物亦不佔優;而市場競爭寬裕的則幾乎沒有成長空間。
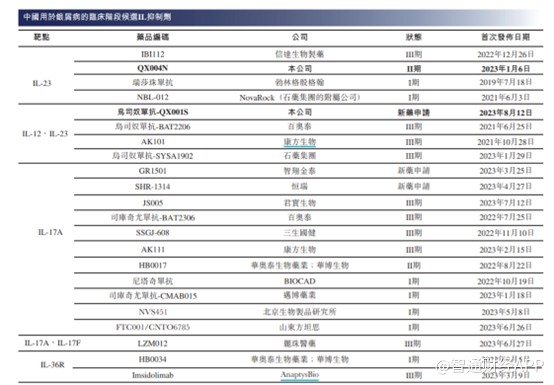
在商業化方面,QX001S是荃信生物預計最先實現商業化的藥物,其是一種用於治療銀屑病(Ps)的IL-12/IL-23p40抑制劑,是首個在中國提交BLA的國產烏司奴單抗生物類似藥,且可能是在中國首個獲批的烏司奴單抗生物類似藥之一。
由於國內用於治療銀屑病藥物的市場競爭激烈,爲了順利推動QX001S商業化,荃信生物與華東醫藥附屬公司中美華東籤訂了QX001S在中國的聯合开發及獨家商業化战略合作協議。根據雙方合作協議,荃信生物從中美華東處收取的首付款及裏程碑付款合計爲5000萬元。就QX001S實現在中國銷售後的累計稅前利潤,還要與中美華東進行五五分成。
根據弗若斯特沙利文的資料,中國很大部分自身免疫性疾病和過敏性疾病患者(例如Ps患者)最初是在地理上分散的廣大地區的當地醫院接受治療。因此,覆蓋範圍廣泛成銷售網絡至關重要。而華東醫藥擁有超過 7000名員工組成的銷售團隊,在糖尿病和自身免疫性疾病等慢性病的管理方面經驗豐富,覆蓋中國超過3000家(或90%以上)三甲醫院和超過15500家二級及以下醫院。因此借助華東醫藥的銷售渠道,QX001S的商業化有望獲得較大的成功。
綜上所述,在新的治療手段以及新產品獲批上市的背景下,中國自身免疫疾病生物藥有望得以快速發展,荃信生物在此背景下獲得諸多機構的加持,身價漲超40倍;不過其兩款核心產品市場競爭過於激烈,能否從中取勝存在極大的不確定性。預期首款商業化的產品QX001S也因行業競爭過於激烈不得不找商業合作夥伴,鑑於中美華東的銷售能力極強,該款藥物上市後有望給荃信生物帶來較爲不錯的收益。